Контрольная
Физическая и коллоидная химия Вариант 20 Контрольная работа № 2, АГМУ
Дата сдачи: Ноябрь 2010
1. Если в разбавленном растворе растворитель подчиняется закону Рауля, то:
а. растворенное летучее вещество в том же растворе подчиняется закону Генри
б. растворенное летучее вещество в том же растворе не подчиняется закону Рауля
в. растворенное летучее вещество в том же растворе подчиняется закону Рауля
2. Наибольшую температуру кипения имеет:
а. летучий растворитель
б. разбавленный 0,001 А раствор нелетучего вещества
в. разбавленный 0,001 М раствор летучего вещества
3. Кристаллы растворителя находятся в равновесии с раствором
а. при температуре начала кристаллизации
б. давлении насыщенного пара над кристаллами и над раствором одинаковы
в. давление насыщенного пара над кристаллами меньше, чем над раствором
г. давление насыщенного пара над кристаллами растворителя больше. чем над раствором
4. Кислотная буферная система состоит из:
а. слабого основания и его соли, образованной сильной кислотой
б. сильной кислоты и ее соли, образованной слабым основанием
в. солей. Образованных слабой многоосновной кислотой и сильным основанием
г. слабой кислоты и ее соли, образованной сильным основанием
д. солей, образованных одноосновной кислотой и одноосновным основанием
5. По уравнению ![]() можно рассчитать:
можно рассчитать:
а. потенциальную кислотность
б. изменение рН при незначительном разбавлении
в. общий объем буферной системы
г. объемы компонентов, необходимых для приготовления определенного объема буфера с заданным значением рН, при известных концентрациях компонентов
д. соотношение компонентов в буфере при заданном значении рН
6. При добавлении незначительного количества кислоты к ацетатному буферу:
а. концентрация [H+] – ионов рН практически не изменяется
б. потенциальная кислотность увеличивается
в. увеличивается общая кислотность
г. увеличивается количество сопряженного основания
д. протекает реакция: CH3COO- + H3O+ ↔ H2O + CH3COOH
7. Предельный закон Дебая справедлив
а. в водных растворах с концентрацией 0,01 моль/л
б. в водных растворах с ионной силой, равной или меньшей 10-2
в. в неводных растворителях с низкой диэлектрической проницаемостью
г. в неводных растворителях с низкой диэлектрической проницаемостью с концентрацией электролита меньше 0,01 моль/л
д. в растворах сильных электролитов с концентрацией 1 моль/л
8. Уравнение ![]() справедливо для:
справедливо для:
а. любого электролита
б. любого слабого электролита
в. слабого бинарного электролита
г. бинарного электролита, децимолярный раствор которого имеет степень диссоциации 3%
д. бинарного электролита, децимолярный раствор которого имеет степень диссоциации 0,3%
9. Величина эквивалентной электропроводности при предельном разведении не зависит от:
а. концентрации электролита
б. природы растворителя
в. степени диссоциации электролита
г. абсолютных скоростей движения ионов
10. Укажите оси координат, в которых для реакции третьего порядка зависимости носят линейный характер:
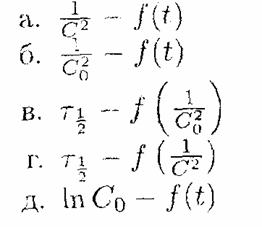
11. Если скорость химической реакции ![]() описывается уравнением
описывается уравнением ![]() , то при k1 >> k2 оно принимает вид:
, то при k1 >> k2 оно принимает вид:
а. V = k1 · C0(A) · e-k1t
б. V = k2 · C0(A) · e-k2t
12. При постоянной температуре и одинаковых концентрациях исходных веществ две реакции типа 2А(г) + 3В(г) ↔ 2АВ3(г) различаются скоростями:
а. при различных константах скорости этих реакций
б. при различной энергии активации
в. при различных температурных коэффициентах
13. Раздробленность дисперсной фазы характеризуют:
а. степенью дисперсности
б. удельной абсорбцией
в. суммарной площадью границы раздела фаз, приходящейся на единицу объема дисперсной фазы
14. Поверхностное натяжение индивидуальной жидкости:
а. уменьшается с ростом температуры
б. увеличивается с ростом температуры
в. вблизи критической температуры становится равным нулю
15. Поверхностная активность зависит от:
а. природы ПАВ
б. строения ПАВ
в. концентрации ПАВ
г. природы границы раздела фаз
16. При понижении температуры адсорбционное равновесие на границе «жидкость - газ» сместится в сторону:
а. адсорбции
б. десорбции
17. В золях интенсивность рассеянного света:
а. пропорциональна частичной концентрации
б. обратна пропорциональна длине волны падающего светового потока
в. пропорциональна квадрату объема частицы
г. пропорциональна шестой степени радиуса частицы
д. не зависит от показателей преломления дисперсной фазы и дисперсионной среды
18. Знак заряда собственно коллоидной частицы определяется:
а. знаком заряда термодинамического потенциала
б. знаком заряда потенциалообразующих ионов
в. знаком заряда гранулы
г. знаком заряда потенциала электрофореза
д. знаком заряда противоионов
19. Перезарядку вызывают ионы:
а. имеющие максимальный по абсолютной величине заряд
б. имеющие заряд одинаковый с противоионами и неспособные достраивать кристаллическую структуру агрегата
в. имеющие заряд противоположный по знаку заряду потенциалопределяющих ионов и способные достраивать кристаллическую структуру агрегата
г. имеющие высокий заряд и одинаковые по знаку с потенциалопределяющими ионами
20. Чередование зон коагуляции…
а. характерно для электролитов, коагулирующие ионы которых – поливалентны (Fe3+, Th4+, Cr3+ )
б. происходит под влиянием индифферентного иона, имеющего заряд одинаковый по знаку с потенциал определяющими ионами
в. происходит под влиянием неиндифферентного иона, заряженного противоположно коллоидной частице
21. При добавлении 7 мл 0,01 М HCl к буферу, содержащему 10 мл 0,05 М CH3COONa и 15 мл 0,02 М CH3COOH.
а. 0,16
б. 0,35
в. 0,43
г. 0,52
д. 0,61
22. Если разложение N2O на поверхности золота протекает по уравнению N2O↔ N2 + O2, а константа скорости при 900º С -5 · 10-4 и начальная концентрация N2O 3,2 моль/л, то к моменту разложения 78% начального количества оксида скорость реакции равна:
а. 1,6 · 10-3 моль/л · с
б. 0,8 · 10-3 моль/л · с
в. 3526 · 10-4 моль/л · с
г. 1,76 · 10-4 моль/л · с
д. 2,76 · 10-4 моль/л · с

