Контрольная
Физическая и коллоидная химия Вариант 11 Контрольная работа № 2, АГМУ
Дата сдачи: Октябрь 2010
ЗАДАЧИ РЕШЕНЫ В ПИСЬМЕННОМ ВИДЕ, ПЕРЕВОД В ПЕЧАТНЫЙ ВИД НЕОБХОДИМО ОСУЩЕСТВЛЯТЬ САМОСТОЯТЕЛЬНО
1. Давление насыщенного пара компонента над раствором зависит:
а. температуры
б. концентрации компонентов
в. объема раствора
г. давления насыщенного пара над чистым компонентом
2. Для совершенного бинарного раствора при Т = const справедливы утверждения:
а. закон Рауля соблюдается для каждого компонента раствора Рi = Pi0 · Ni
б. закон Генри соблюдается для каждого компонента
в. ΔVсмешенная = 0; ΔНсмешенная = 0 и Δ Gсмешенная = 0; ΔSсмешенная = 0
г. ΔVсмешенная = 0; ΔНсмешенная = 0 и Δ Gсмешенная < 0; ΔSсмешенная > 0
д. ΔVсмешенная > 0; ΔНсмешенная < 0 и Δ Gсмешенная < 0; ΔSсмешенная > 0
3. Справедливы утверждения:
а. молярный объем всегда больше нуля
б. парциальный молярный объем может принимать любые значения
в. парциальный молярный объем, как и общий объем, может принимать только положительные значения
г. так если молярный объем всегда положительный, то парциальный молярный объем всегда отрицательный
4. Обладают буферным действием:

5. По уравнению ![]() можно рассчитать:
можно рассчитать:
а. потенциальную кислотность
б. изменение рН при незначительном разбавлении
в. общий объем буферной системы
г. объемы компонентов, необходимых для приготовления определенного объема буфера с заданным значением рН, при известных концентрациях компонентов
д. соответствие компонентов в буфере при заданном значении рН
6. При добавлении незначительного количества кислоты к ацетатному буферу:
а. концентрация [H+] – ионов и рН практически не изменяется
б. потенциальная кислотность увеличивается
в. увеличивается общая кислотность
г. увеличивается количество сопряженного основания
д. протекает реакция: CH3COO- + H3O+ ↔ H2O + CH3COOH
7. Предельный закон Дебая справедлив
а. в водных растворах с концентрацией 0,01 моль/л
б. в водных растворах с ионной силой, равной или меньше 10-2
в. в неводных растворителях с низкой диэликтрической проницаемостью
г. в неводных растворителях с низкой диэлектрической проницаемостью с концентрацией электролита меньше 0,01 моль/л
д. в растворах сильных электролитов с концентрацией 1 моль/л
8. Из закона Дебая – Хюккеля следует, что:
а. ионный коэффициент активности не зависит от природы электролита
б. по мере роста концентрации коэффициент активности падает. Проходит через минимум, а затем возрастает, превышая единицу в концентрированных растворах
в. в сильно разбавленных растворах средний ионный коэффициент активности не зависит от природы электролита в пределах данного валентного типа и определяется величиной ионной силы
9. Величина эквивалентной электропроводности при предельном разведении не зависит от:
а. концентрации электролита
б. природы растворителя
в. степени диссоциации электролита
г. абсолютных скоростей движения ионов
10. Пределом протекания обратимых реакций при заданных условиях является:
а. равенство констант скоростей прямой и обратной реакции
б. равенство скоростей прямой и обратной реакции
в. протекание прямой и обратной реакции по одинаковому порядку
11. Укажите оси координат, в которых для реакции третьего порядка зависимости носят линейный характер:
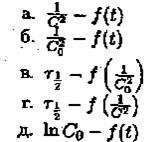
12. Если реакция автокатализируется промежуточными продуктами то:
а. временной порядок выше концентрационного
б. временной порядок меньше концентрационного
в. концентрационный порядок выше временного
г. концентрационный и временной порядки совпадают
13. Растворение какого-либо вещества в жидкости может:
а. повышать поверхностное натяжение растворителя (σР-Р > σО)
б. понижать поверхностное натяжение растворителя (σР-Р < σО)
в. практически не влиять на поверхностное натяжение растворителя (σР-Р = σО)
14. Поверхностно-инактивными веществами являются:
а. глицерин
б. сахароза
в. этилацетат
г. сульфат магния
д. α-аминопентановая кислота
15. Коэффициенты в уравнении Фрейндлиха можно определить из графика зависимости:
а. С/Г = f(C)
б. Г = f(C)
в. lgГ = f(lgC)
г. σ = f(C)
д. Г/C = f(C)
16. При понижении температуры адсорбционное равновесие на границе «жидкость-газ» сместится в сторону:
а. адсорбции
б. десорбции
в. lgГ = f(lgC)
г. σ = f(C)
д. Г/C = f(C)
17. Из уравнения δQ = -D · (dC/dx) · S · dt следует что:
а. масса диффундирующго вещества пропорциональна скорости диффузии
б. масса диффундирующго вещества пропорциональна коэффициенту диффузии
в. поток диффузии пропорционален градиенту концентрации
г. скорость диффузии пропорциональна времени течения процесса
д. скорость диффузии пропорциональна градиенту концентрации
18. Знак заряда собственно коллоидной частицы определяется:
а. знаком заряда термодинамического потенциала
б. знаком заряда потенциалообразующих ионов
в. знаком заряда гранулы
г. знаком заряда потенциала электрофореза
д. знаком заряда противоионов
19. Если при добавлении неиндифферентного электролита к золю {m(CaCO3)nCa2+ · 2(n - x)Cl-}2x · 2xCl- происходит перезарядка, сопровождающаяся изменением знака заряда всех потенциалов, кроме термодинамического, то этот электролит:
а. Ca(NO3)2
б. CaCl2
в. K2CO3
г. K3PO4
д. (NH4)2SO4
20. Коагулирующая активность ионов возрастает в ряду:
а. Li+, Na+, K+, Rb+
б. Cl-, Br-, I-, CNS-
в. Rb+, Na+, K+, Li+
г. SO2-, Cl-, CNS-. Br-, I-, NO3-
д. Mg2+, Ca2+, Sr2+, Ba2+
21. Если две одноосновные органические кислоты при некоторой концентрации имеют разные степени диссоциации (a1 = 0,2, a2 = 0,5), то соотношение констант диссоциации…
а. K1 = K2
б. K1 = 2K2
в. K1 = 10K2
г. K2 = 10K1
д. K2 = 5K1
22. Разбавление водой в 10 раз децимолярного раствора гидроксида натрия приводят к …
а. увеличению рОН на единицу
б. увеличению рОН в 10 раз
в. уменьшению рОН на единицу
г. увеличению рН на единицу
д. уменьшению рН на единицу

