Контрольная
Физическая и коллоидная химия Вариант 11 Контрольная работа № 1, АГМУ
Дата сдачи: Октябрь 2010
ЗАДАЧИ РЕШЕНЫ В ПИСЬМЕННОМ ВИДЕ, ПЕРЕВОД В ПЕЧАТНЫЙ ВИД НЕОБХОДИМО ОСУЩЕСТВЛЯТЬ САМОСТОЯТЕЛЬНО
1. В термодинамике теплота процесса считается положительной:
а если получена системой от окружающей среды
б. при переходе теплоты от системы к ее окружению
2. Если процесс изобарический, то:
а. Т = const
б. ΔT = const
в. δQ = δA
г. δQ = dU
д. δA = -dU
3. Работу расширения (сжатия) в изобарическом процессе можно рассчитать по формуле:
а. A = nRTln(V2/V1)
б. A = ΔnRT
в. A = nR(T2 – T1)
г. A = P(V2 – V1)
д. A = nRTln(P1/P2)
4. Если при температуре 298 К и постоянном давлении протекает реакция СН4 + 2О2 = СО2 + 2Н2О(ж) + 212,8 ккал/моль, то:
а. объемы продуктов реакции и исходных веществ одинаковы
б. внешнее давление совершает работу над системой
в. теплосодержание системы понижается
г. тепловой эффект реакции при постоянном давлении на 2369 кал больше, тепловой эффект при постоянном объеме
д. процесс идет с уменьшением числа моль газообразных компонентов
5. Разность между Ср и Сv:
а. практически равна нулю для жидких и твердых тел
б. равна работе расширения при нагревании 1 моль газа на 1К
в. практически равна нулю для веществ, находящихся в газообразном состоянии
г. достаточно велика и ее надо учитывать для газов
6. Теплота сгорания нитрофенола это:
а. тепловой эффект окисления нирофенола до CO2(Г), H2O(ж), N2(г)
б. тепловой эффект реакции окисления нирофенола, рассчитанный на основании следствия из закона Гессе, как ΔHt(T)0 = ∑vΔHf(T)0прод + ∑vΔHf(T)0исх
в. тепловой эффект реакции окисления нитрофенола, рассчитанный на основании следствия из закона Гессе, как ΔHat(T)0 = ∑vΔHC(T)0исх + ∑vΔHС(T)0прод
г. тепловой эффект реакции окисления нитрофенола, рассчитанный на основании следствия из закона Гессе, как ΔHat(T)0 = ∑vΔHC(T)0прод + ∑vΔHС(T)0исх
7. Если процесс увеличивает энтропию изолированной системы, то:
а . прекращение всех процессов произойдет, когда энтропия системы достигнет минимального значения
б. установление устойчивого равновесного состояния произойдет, когда энтропия достигнет максимального значения
в. прекращение всех процессов произойдет в состоянии равновесия
8. Справедливо соотношение:
а. Sгаза = Sжидкости = Sтвердого тела
б. Sгаза > Sжидкости > Sтвердого тела
в. Sгаза > Sжидкости = Sтвердого тела
г. Sгаза < Sжидкости < Sтвердого тела
9. Так как энтропия представляет меру беспорядочности молекулярного состояния системы, то:
а. наличие примесей и дефектов в кристаллической решетке увеличивает энтропию
б. газообразному состоянию свойственна наибольшая энтропия
в. наличие примесей и дефектов в кристаллической решетке уменьшает энтропию
г. энтропия кристалла с идеальной кристаллической решеткой при абсолютном нуле равна нулю
10. Характеристические функции – это критерии вероятности процессов в системах:
а. изолированных
б. неизолированных
в. закрытых
г. открытых
11. Внутренняя энергия – это функция от переменных:
а. температуры
б. давления
в. объема
г. энтропии
д. энтальпии
12. В неизолированных системах при соответствующих условиях в ходе самопроизвольных процессов…
а. все характеристические функции убывают
б. все характеристические функции убывают и достигают минимума при равновесии
в. убывают лишь те характеристические функции, которые имеют размерность энергии
13. Если изменение числа молей газообразных участников реакции равна нулю, то…
а. КP = KC = KN
б. КP = KN
в. KC = KN
г. КP = КC
д. КP = KN, но а. КP не = КC
14. В уравнении изотермы химической реакции кр и кр¢ это:
а. константы равновесия реакции
б. величины. Равные друг другу при стандартных условиях
в. величины, одна из которых (кр) рассчитана через равновесные концентрации
г. величины, одна из которых (Кр) рассчитана через парциальные давления, с которыми компоненты вводятся в реакционную смесь
д. константы, рассчитанные через концентрации исходных веществ
15.Химическая реакция является самопроизвольной до тех пор, пока…
а. сумма химических потенциалов всех компонентов реакции не станет больше нуля
б. не достигнуто химическое равновесие между реагирующими веществами
в. не выровнялись скорости прямой и обратной реакций
г. не достигнуто постоянство состава системы
16. Аналитический вид зависимости Кх от давления устанавливает уравнение (если Х-мольная доля) …
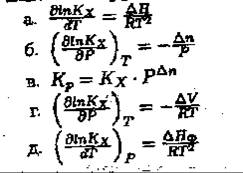
17. Если D Нх – это молярная теплота фазового перехода, то для равновесия жидкость « пар уравнение Клапейрона – Клазиуса принимает вид:
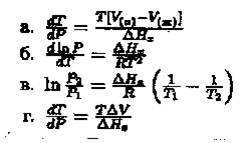
18. На диаграмме состояния серы одновариантными, удовлетворяющими условию С = 1 – 2 + 2 = 1 являются…
а. одна система
б. две системы
в. три системы
г. пять систем
д. шесть систем
19. Если кристаллическое соединение при плавлении обратимо разлагается, образуя жидкость другого состава и новую твердую фазу, то такой процесс называют…
а. конгруэнтным плавлением
б. инконгруэнтным плавлением
в. образованием жидкой эвтектики
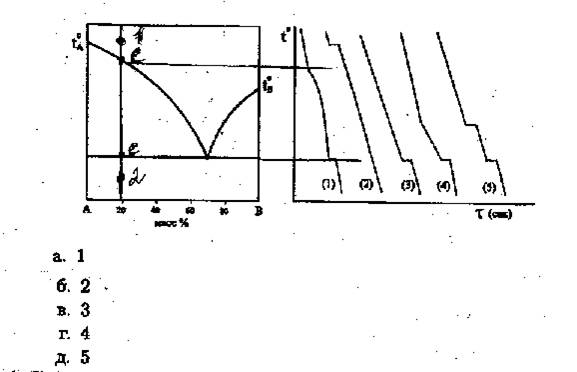
20. Путь кристаллизации системы, содержащей 80% А, описывается кривой охлаждения:
21. Тепловой эффект реакции 2 Fe + 3/2O2 = Fe2O3 при постоянном объеме и температуре 291 К равен – 819,67 кДж/моль, тогда тепловой эффект при постоянном давлении для той же реакции при той же температуре равен:
а. 823,3 кДж/моль
б. 1646,6 кДж/моль
в. -823,3 кДж/моль
г. -1646.6 кДж/моль
д. -9291.1 кДж/моль
22. Стандартные теплоты образования оксида азота (II) и воды соответственно равны 9,667 кДж/моль и 9-286,04) кДж/моль, то стандартный тепловой эффект реакции N2O4 (г) + 4Н2 (г) = N2 (г) + 4H2O (ж) равен:
а. -286,37 кДж
б. 1134,5 кДж
в. -1153 кДж
г. -1134,5 кДж

