Контрольная
Барнаул Вариант 17 Контрольная работа 1
Дата сдачи: Январь 2010
ЗАДАЧИ РЕШЕНЫ В ПИСЬМЕННОМ ВИДЕ, ПЕРЕВОД В ПЕЧАТНЫЙ ВИД НЕОБХОДИМО ОСУЩЕСТВЛЯТЬ САМОСТОЯТЕЛЬНО
1. Внутренняя энергия 1 моль идеального газа зависит от :
а. Массы
б. температуры
в. давления
г. объема
д. природы вещества
2. Если совершается адиабатический процесс при постоянном давлении без совершения полезной работы - то:
а. ΔH = 0
б. ΔU = 0
в. ΔH = ΔU + pΔV
г. ΔH = const
д. ΔU = const
3. Если процесс изобарический, то:
а. ΔР = const
б.ΔH = Q
в. Qp = ΔU + p ΔV
г. dH = dU + pdV
4. Если протекает реакция С + ½ О2 = CO ΔH0298 = -107,68 кДж/моль то:
а. при образовании одного моль оксида углерода (II) при постоянном давления выделится на 1218 Дж больше, чем при постоянном объеме
б. при образовании одного моль оксида углерода (II) при постоннном объеме выделится на 1218 Дж больше, чем при постоянном давлении
в. при образовании одного моль оксида углерода (II) при постоянном объеме выделится на 1218 Дж меньше, чем при постоянном давлении
5. Отношение бесконечно малого количества теплоты, которое нужно подвести к единице количества вещества, к бесконечно, малому приращению температуры, которое при этом наблюдается, называют:
а. истинной малярной теплоемкостью
б. средней молярной теплоемкостью
в. истинной удельной изобарной теплоемкостью
г. истинной теплоемкостью
6. Если с ростом температуры тепловой эффект реакции уменьшается, то:
а. температурный коэффициент теплового эффекта реакции больше нуля
б. температурный коэффициент теплового эффекта реакции меньше нуля
в. изменение теплоемкости в ходе реакции меньше нуля
7. Выражение dS > 0:
а. это неравенство - критерий самопроизвольного процесса
б. означает, что в системе при V = consi и U = const возможны без затраты энергии любые процессы
в. означает, что в изолированной системе возможны процессы, в результате которых энтропия возрастает
г. означает, что в любом процессе энтропия возрастает
8. Энтропия это:
а. критерий возможности, направления и предела протекания процессов при δQ = 0, a U, V = const
б. мера упорядоченности системы
в. мера хаотичности
г. мера связанной энергии
д. вероятность нахождения системы в данном состоянии
9. Изменение энергии в химических реакциях при стандартных условиях можно рассчитать:
а. ΔSреакции = ∑(nS0298)прод - ∑(nS0298)исх
б. ΔSреакции = ∑(nS0298)прод + ∑(nS0298)исх
в. ΔSреакции = ∑(nS0298)нач + ∑(nS0298)исх
10. Размерность энергии имеют:
а. изобарно - изотермический потенциал
б. изохорно - изотермический потенциал
в. энтропия
г. энтальпия
д. внутренняя энергия
11. Являются функциями состояния:
а. H, U, G, Q
б. Q, F, S, Ap, Qp
в. H, U, G, Qp, S
г. G, F, S, H, U, Q
12. Полезная работа в необратимом процессе при Р, Т = const
а. Аn = -ΔG
б. Аn = -ΔF
в. Аn < -ΔG
г. Аn < -ΔF
д. Аn ≤ -ΔU
13.Константа Кр и KN связаны соотношением:
a. Кр = KN· рΔn
б. Кр = KN· р-Δn
в. Кр = Kp· рΔn
г.Кр = KN·(RT/P)Δn
д.Кр = KN · (P/RT)Δn
14. В уравнении изотермы химической реакции кр и k'p это:
а. константы равновесия реакции
б. величины, равные друг другу при стандартных условиях
в. величины, одна из которых (кр) рассчитана через равновесные концентрации
г. величины, одна из которых (к'р) рассчитана через парциальные давления, с которыми компоненты вводятся в рекционную смесь
15. Химическая реакция является самопроизвольной до тех пор, пока...
а. сумма химических потенциалов всех компонентов реакции не станет больше нуля
б. не достигнуто химическое равновесие между реагирующимя веществами
в. не вьгравнялпсь скорости прямой и обратной реакций
г. не достигнуто постоянство состава системы
16. При понижения температуры равновесие смещается в сторону продуктов в реакции:
а.СО + 2H2 ↔ СH3ОН + 113,13 кДж
б. N2O4↔ 2NO2- 56,98кДж
в. N2+ 3H2 ↔2NH3 + 92,18 кДж
г. N2 + 02 ↔ 2NO - 181,0 кДж
д. S02 + 1/2O2 ↔ S03 + 94,27кДж
17. Если ΔHx - это мерная теплота фазового перехода, то для равновесия жидкость ↔ пар уравнение Клапейрона - Клаузиса принимает вид:

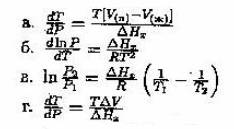
18. На диаграмме состояния воды линия ОВ отражает зависимость ...
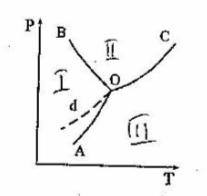
а. давления насыщенного пара над жидкой водой от температуры
б. температуры плавления льда от давления
в. давления насыщенного пара надо льдом от температуры
19. Неограниченной растворимостью в твердом состоянии обладают
а. изоморфные вещества
б. неизоморфные вещества
20. По «правилу рычага»отношение количеств равновесных фаз...
а. обратно пропорционально отношению отрезков, отсекаемых на ноде ординатой общего состава системы
б. прямо пропорционально отношению отрезков, отсекаемых на ноде ординатой общего состава системы
21. При 25º С разность между теплотой при постоянном давлении и теплотой при постоянном объеме для реакции горения водорода с образованием воды в жидком состоянии равва:
а. 7432Дж
б. 2477,6 Дж
в. 9910,3 Дж
г. 12,39 Дж
22. Если известны тепловые эффекты реакций
2Р + 5/2O2 = P2O5 + 1508,4 кДж/моль
H2 + 1/2O2 = H2O(ж) + 285,0 кДж/моль
2Р + H2+ 3O2 = 2HРO3 + 1912,3 кДж/моль,
а взаимодействие пентаоксида фосфора с водой протекает в соответствии с уравнением P2O5 + Н2О = 2НРО3 и в реакцию введены 30 кг Р2О5, то тепловой эффект реакции составит:
а. -25130 кДж
б. -25,13 кДж
в. -429,29 · 103 кДж
г. 25130 кДж
д. 429629 кДж

