Контрольная
Барнаул Вариант 19 Контрольная работа 1
Дата сдачи: Август 2011
ЗАДАЧИ РЕШЕНЫ В ПИСЬМЕННОМ ВИДЕ, ПЕРЕВОД В ПЕЧАТНЫЙ ВИД НЕОБХОДИМО ОСУЩЕСТВЛЯТЬ САМОСТОЯТЕЛЬНО
Решения на 16 задачу НЕТ
1. Термодинамическая система:
а. может находиться во взаимодействии с окружающей средой
б. описывается совокупностью термодинамических параметров
в. обязательно имеет внешнюю сферу
г. всегда изолирована от окружающей среды и находится с ней во взаимодействии
2. Верно ли утверждение о том, что нагретое тело обладает некоторым запасом теплоты:
а. да
б. нет
3. Формулы, пригодные для расчета работы расширения (сжатия) только идеального газа:
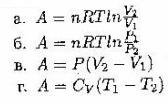
4. Приняты за нуль…
а. теплоты образования простых веществ, отнесенные к 1 моль вещества
б. стандартные теплоты образования простых веществ в устойчивом агрегатном состоянии
в. стандартные теплоты образования простейших оксидов в устойчивых состояниях
г. теплоты образования простых веществ, отнесенные к 1 моль вещества при 298К и давлении 101325 н/м2
5. Теплоемкость
а. зависит от природы нагреваемого вещества
б. зависит от нагреваемого вещества
в. зависит от температуры
г. зависит от того, каким путем проводили нагревание
д. не зависит от того, каким путем проводили нагревание
6. Если для некоторой химической реакции изменение теплоемкости как функции температуры выражается уравнением ΔCp = Δa + Δb + ΔcT2, Δa, Δb, Δc больше нуля, то:
а. с ростом температуры энтальпия процесса увеличивается
б. с ростом температуры энтальпия процесса уменьшается
в. при понижении температуры энтальпия увеличивается
г. при понижении температурта
д. энтальпия зависит от температуры
7. Если для некоторой системы dU = 0, V = const, то:
а. в самопроизвольном процессе dS > 0
б. в самопроизвольном процессе dS < 0
в. в равновесном процессе dS = 0
г. в равновесном процессе S = const
д. в не самопроизвольном процессе dS < 0
8. Энтропия сжатого газа:
а. равна энтропии разряженного газа
б. меньше энтропии разряженного газа
в. больше энтропии разряженного газа
9.справедливо уравнение:
а. δАln ≥ TdS – dU + PdV
б. δАln ≥ TdS – dU – PdV
в. δАln ≤ TdS – dU – PdV
г. δАlmax = TdS – dU – PdV
д. δАlmax = TdS + dU – PdV
10. Для некоторой функции «Х», критерия вероятности самопроизвольных процессов при S,V = const, определительное уравнение имеет вид:
а. X = U + pV
б. X = TS – pV
в. X = U – TS
г. X = H – TS
д. X = F + pV
11.Если критерием самопроизвольности является уменьшение энергии Гиббса, то процесс протекает в системе:
а. изолированной при U, V = const
б. изотермической при V = const
в. изотермической при Р = const
г. закрытой при P,S = const
д. закрытой при V,S = const
12. Математически условия устойчивого равновесия в изолированной при U,V = const можно записать:
а. ΔU = 0
б. ΔG = 0
в. ΔF = 0
г. ΔS = 0
д. ΔН ≤ 0
13. В случае гетерогенных реакций в выражение константы химического равновесия (Кр) вводит…
а. парциальные давления (или концентрации) только газообразных участников реакции
б. парциальные давления (или концентрации) всех участников реакции
в. парциальные давления (или концентрации) веществ в твердом и жидком состояниях
14. Если для реакции bB + dD = rR + gG k’p < kp, то…
а. реакция идет самопроизвольным взаимодействием веществ B и D и образованием продуктов R и G
б. kp с течением времени увеличивается
в. P’B и P’D с течением времени уменьшаются
г. реакция идет в обратном направлении
д. kp с течением времени уменьшается
15. Если реакция экзотермическая, то …
а. температурный коэффициент константы равновесия положительный
б. температурный коэффициент константы равновесия отрицательный
в. температурный коэффициент теплового эффекта химической реакции отрицательный
г. температурный коэффициент теплового эффекта химической реакции положительный
16. НЕТ
17. Для процессов испарения (кроме критического состояния можно утверждать, что …
а. с повышением внешнего давления температура кипения жидкости увеличивается
б. с повышением внешнего давления температура кипения жидкости понижается
18. Если система однокомпонентна и однофазна, то …
а. она моновариантна
б. в таких системах не изменяя числа и вида фаз, можно изменить произвольно (в известных пределах) либо температуру, либо давление
в. в таких системах не изменяя числа и вида фаз, можно изменить произвольно (в известных пределах) независимо друг от друга и температуру и давление
19. Для системы с полной нерастворимостью компонентов в твердом состоянии справедливы утверждения:
а. линии солидуса и эвтектики совпадают
б. в точках на линии ликвидуса системы моновариантны
в. при совместной кристаллизации компонентов исчезают последние капли жидкости эвтектического состава
г. в точках на линии солидуса системы моновариантны
д. при перетектической температуре происходит инконгруэнтное плавление химического соединения
20. Из диаграммы состояния следует, что для системы, содержащей 50 масс % А можно записать «правило рычага»…
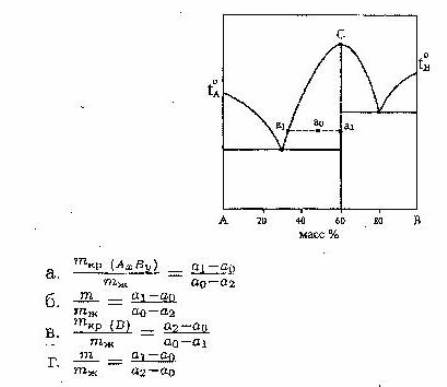
21. 6 кг. водорода при повышении температуры на 12º Спри постоянном давлении могуьт совершить работу:
а. 593.9 кДж
б. 296.95 кДж
в. 0.594 кДж
г. 890.85 кДж
22. Если при некоторой температуре теплоты сгорания этана, мета, ацетилена и водорода (кДж / моль) соответственно равны 1560; 890,2; 1299,0; 285,9, то стандартная теплота реакции дегидрирования этана 2С2Н6 = 2СН4 + С2Н2 + Н2 равна:
а. 245,3 кДж
б. -122,65 кДж / моль
в. -245,3 кДж
г. 122,65 кДж / моль

